Como funciona?
A cada uma das especialidades comercializadas é atribuída uma identificação individual e única para a realização deste acompanhamento, de forma a garantir o controlo dos produtos e contribuir para a erradicação da circulação dos ilegítimos. É possível serializar a embalagem primária, secundária ou terciária dos produtos, dependendo da regulamentação de cada país ou da solução necessária.
30%
De acordo com uma estimativa da OMS, em países emergentes e em desenvolvimento, até 30% de todos os medicamentos são falsificados. E nos países desenvolvidos, os medicamentos falsificados representam 7-15% de todos os medicamentos em circulação.
35.000u$s
. Isso representa cerca de US $ 35 bilhões anuais (medicamentos falsificados) em fraudes e perdas tanto para os estados quanto para as empresas que os comercializam.
75%
De acordo com relatórios, no final de 2018 ou início de 2019, aproximadamente 75% dos medicamentos prescritos no mundo serão cobertos pela lei de serialização e rastreabilidade.
Principais benefícios
Reduz ou elimina produtos falsificados.
Facilita o controle de estoque e estoque.
Melhora os tempos de envio e recepção.
Permite controlar a distribuição dos produtos em toda a cadeia de comercialização.
O cliente recebe medicamentos com legitimidade, qualidade, eficácia, segurança garantida e comprovada.
Reduz os custos logísticos, pois detecta deficiências antes do embarque do produto.
Serialização. Codificação de rastreabilidade

Dados sob os padrões GS1:
(01) GTIN
(21) Número de série
(17) Data de vencimento
(10) Número do lote
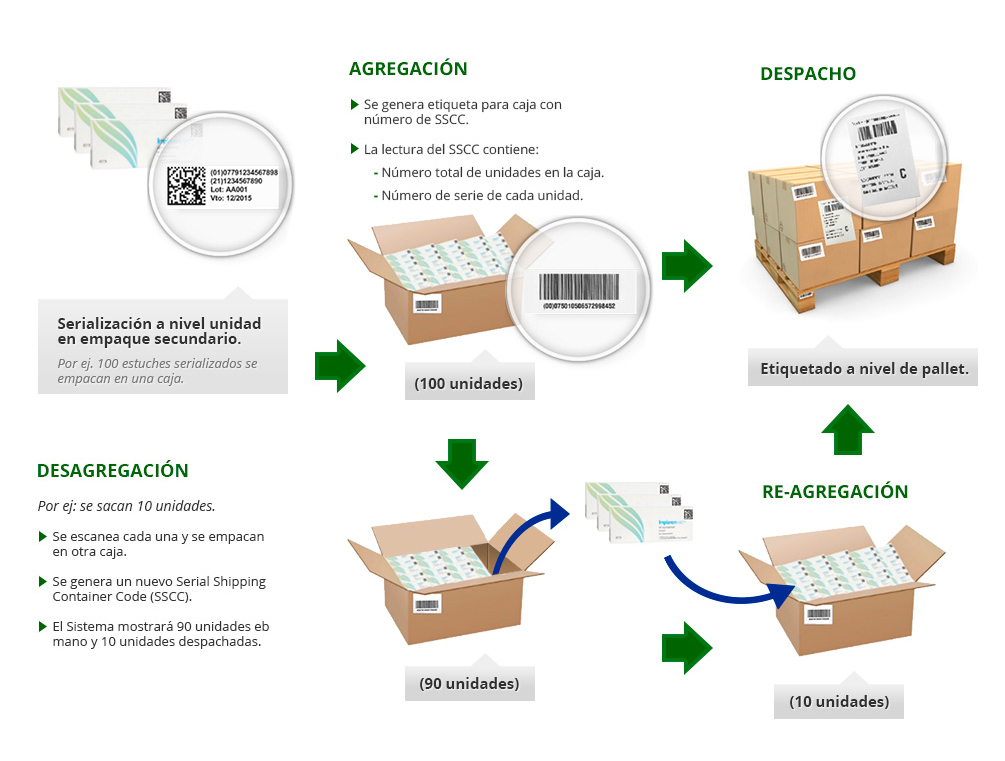
Serialização e agregação
Tecnologías de identificación soportadas
RFID

CÓDIGO DE BARRAS LINEAL

DATAMATRIX

Solução de verificação para medicamentos e produtos médicos
para regulamentações internacionais de serialização e rastreabilidade atuais
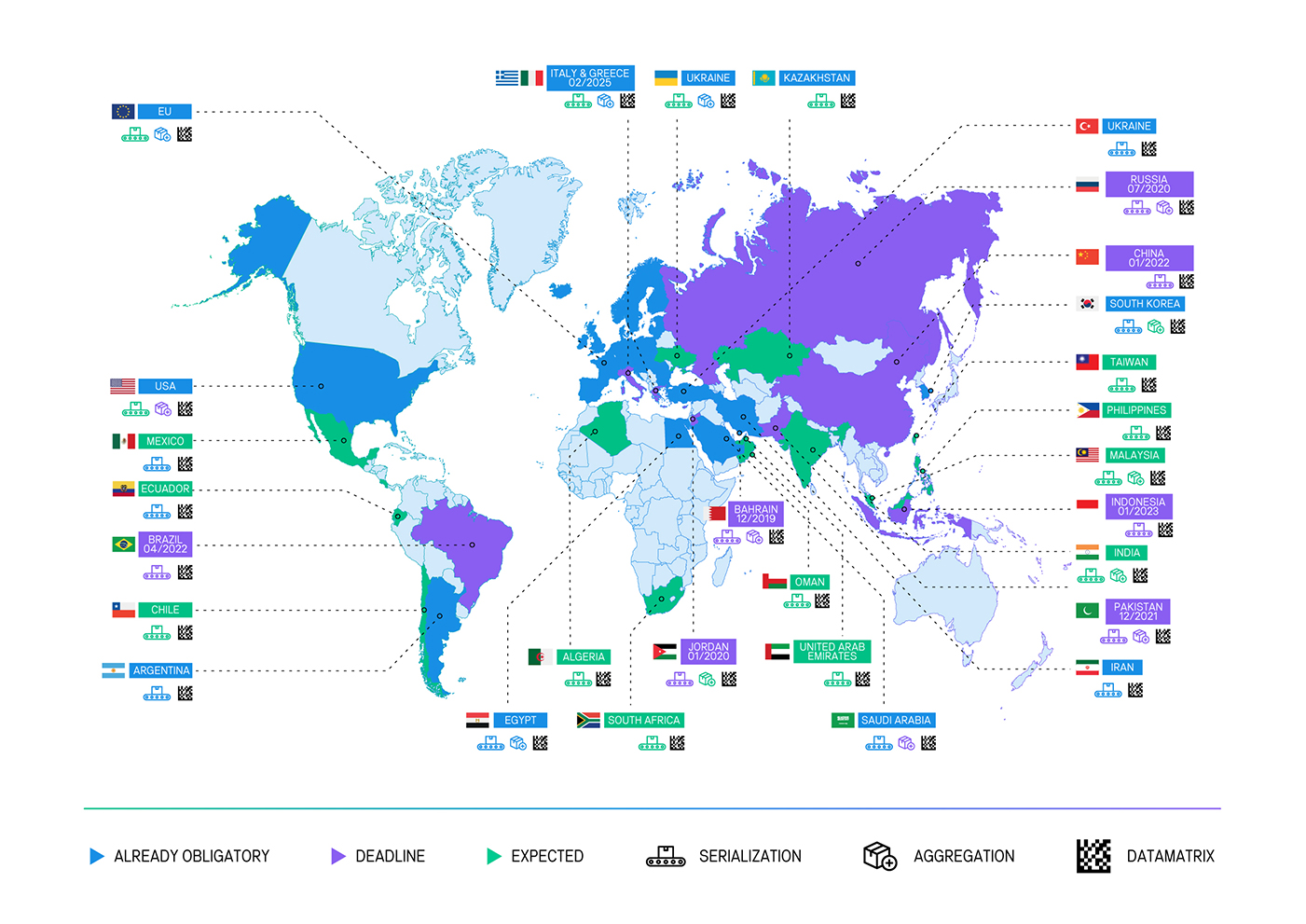
 China
China
Agencia gubernamental: CFDA (China Food and Drug Administration).
Normativa: Mandatory coding for EDL (Essential Drug List) products.
Alcance de la regulación: serialización e informe.
Alcance de productos: todos los productos farmacéuticos.
Participantes: fabricantes, distribuidores mayoristas y farmacias.
Plazo: 31/12/2015, para todos los medicamentos.
Codificación: el gobierno creó una codificación de 20 dígitos EDMC (Electronic Drug Monitoring Code).
Reporte: carga manual de informes en el portal del gobierno de China.
Estado: suspendido temporariamente.
 Estados Unidos
Estados Unidos
Agencia gubernamental: FDA (Food and Drug Administration).
Normativa: Drug Supply Chain Security Act (DSCSA).
Alcance regulatorio: serialización, seguimiento y verificación.
Alcance de productos: la mayoría de los productos farmacéuticos.
Participantes: fabricantes, distribuidores, dispensadores (farmacias, hospitales).
Plazos: 7/2015 para dispensadores, 11/2017 para los fabricantes.
Estado: en marcha.
 India
India
Agencia gubernamental: DGFT (Directorate General of Foreign Trade (DGFT).
Normativa: MoHFW (Ministry of Health and Family Welfare). Implementation of the Track and Trace system for export of Pharmaceuticals and drug consignments.
Alcance regulatorio: códigos de barra y serialización, agregación e informes.
Alcance de productos: todos los productos farmacéuticos.
Participantes: fabricantes, distribuidores y dispensadores (farmacias y hospitales).
Plazos: marzo de 2016 o 2017, dependiendo de la clasificación de cada compañía.
Codificación: Estándar GS1.
Reporte: presentación de informes al portal de DAVA (Drugs Authentication and Verification Application).
Estado: en marcha.
 Ecuador
Ecuador
Agencia governamental: ARCSA, Agencia Nacional de Regulación, Control y Vigilancia Sanitaria.
Normativa: Resolución ARCSA-DE-013-2020-MAFG
Alcance regulatorio: Identificación individual y unívoca, verificación, seguimiento y reportes.
Alcance de productos: https://www.controlsanitario.gob.ec/wp-content/uploads/downloads/2020/12/resolucion_arcsa-de-033-2020-mafg.pdf
Participantes: Medicamentos, productos biológicos y dispositivos médicos.
Plazos: 6 meses + fases.
Codificación: Estándar GS1.
Reporte: fabricantes que relatam a ARCSA, Agencia Nacional de Regulación, Control y Vigilancia Sanitaria.
Estado: normativa expedida.
 Corea del Sur
Corea del Sur
Agencia gubernamental: KFDA (Korea Food and Drug Administration).
Normativa: Ministry of Health and Welfare notification 2011- 58, «Controlling and indicating barcodes of pharmaceutical products.
Alcance regulatorio: serialización.
Alcance de productos: todos los productos farmacéuticos.
Participantes: fabricantes, importadores, distribuidores mayoristas.
Plazo: julio 2016 (para fabricantes).
Codificación: Estándar GS1.
Reporte: requisito de informes para los fabricantes en 2016, y 2017 para los distribuidores mayoristas.
 UE
UE
Agencia gubernamental: regulado a nivel de país, guiado por la Organización Europea de Verificación de Medicamentos (EMVO).
Normativa: Falsified Medicines Directive (FMD) / Delegated Act on safety features.
Alcance regulatorio: serialización, informe y verificación de productos.
Alcance de productos: la mayoría de los productos farmacéuticos.
Participantes: todos.
Plazos: febrero de 2019.
Codificación: Estándar GS1.
Reporte: los fabricantes deben informar al Centralizador Europeo (European Hub).
Estado: en marcha.
 Turquía
Turquía
Agencia gubernamental: ITS (Turkish Pharmaceutical Track and Trace System).
Normativa: Amending Regulation Regarding The Packaging and Labelling Of Medicinal Products For Human Use.
Alcance regulatorio: serialización e informe.
Alcance de productos: todos los productos farmacéuticos.
Participantes: fabricantes, distribuidores mayoristas, dispensadores.
Plazos: no hay plazos adicionales previstos (implementado).
Codificación: Estándar GS1.
Reporte: todos los miembros de la cadena de distribución informan al ITS.
Estado: en marcha.
Contato
España
Carr. Fuencarral 22, Alcobendas, 28108
+34 910 601 552
Argentina
Italia 415, 1°, Vicente López
+54011 5263-9757
Brasil
Avenida Paulista, 2073 Horsa II Cj.1702
+55 11 91307-6193
Ecuador
Teresa de Cepeda N34-260 y Av. de la República
Email: info@www.verifarma.com
Se você quiser trabalhar conosco, escreva para nós em info@www.verifarma.com
Estamos aqui para responder a todas as suas perguntas e fornecer informações.